1. Over deze richtlijn
1.1 Inleiding
Dit is de eerste RVP-richtlijn ‘Vaccineren van prematuren in het kader van het Rijksvaccinatieprogramma’. Tot nu toe was het onderwerp beschreven in een addendum van de RVP-richtlijn Uitvoering RVP. De RVP-richtlijn Uitvoering blijft de basis voor de uitvoering van het RVP, ook voor prematuren. Aanvullende informatie specifiek gericht op premature kinderen vindt u in de volgende hoofdstukken. Het eerste deel bevat algemene informatie over de stand van de wetenschap betreft de effecten van het vaccineren van premature kinderen. De hoofdstukken 6 en 7 bestaan uit concrete aanbevelingen.
De richtlijn is opgesteld onder verantwoordelijkheid van het RIVM (Rijksinstituut voor Volksgezondheid en Milieu), door de volgende deskundigen: namens de NVK: René Kornelisse, kinderarts-neonatoloog Erasmus MC, Joanne Wildenbeest, kinderarts-infectioloog UMCU, Patricia Bruijning, kinderarts-epidemioloog UMCU en RIVM. Namens de AJN: Suzanne van de Velden, jeugdarts GGD (Gemeentelijke/gewestelijke gezondheidsdienst) Hart voor Brabant en werkzaam op een prematurenpolikliniek, Gea Vrieze, jeugdarts GGD Hart voor Brabant. Namens het RIVM: Nicoline van der Maas, medisch adviseur en epidemioloog RIVM, Guy Berbers, senior onderzoeker RVP en Ingrid Drijfhout, medisch adviseur RIVM.
Randvoorwaardelijke toetsing vond plaats in het Landelijk RVP Overleg door Actiz, GGD GHOR (Geneeskundige Hulpverleningsorganisatie in de Regio) Nederland, VNG (Vereniging van Nederlandse Gemeenten), IGJ en het ministerie van VWS (Ministerie van Volksgezondheid, Welzijn en Sport). De NCJ organiseerde een inspraakronde onder professionals (jeugdartsen, jeugdverpleegkundigen en kinderartsen). Het definitieve concept is in het Landelijk RVP Overleg voorgelegd aan de vertegenwoordigers van de beroepsgroepen (AJN, V&VN, NVDA en NVK) voor inhoudelijke instemming en gepubliceerd op 18 december 2020.
1.2 Gebruikte definitie prematuriteit
Prematuur geboren kinderen zijn kinderen geboren na een zwangerschapsduur van minder dan 37+0 weken. In 2018 betrof dit 7,1% van de geboren kinderen (Perined).
2. Het immuunsysteem van een prematuur
2.1 Effecten van zwangerschapsduur op immuunsysteem
Premature geboorte is geassocieerd met een grotere gevoeligheid voor infecties vanwege een nog onrijp immuunsysteem en een verminderde overdracht van maternale antistoffen (Bonhoeffer 2006). Bij de geboorte is het immuunsysteem van neonaten aangepast aan de zwangerschap en moet het wel snel kunnen reageren op blootstelling aan vele stimuli in de eerste levensdagen. Het immuunsysteem van prematuren verschilt echter van à terme kinderen (Melville 2013). Prematuren hebben een lager aantal lymfocyten, B-cellen, T-cellen en T-helpercellen bij de eerste vaccinatie op de leeftijd van 2 maanden. Op de leeftijd van 7 maanden is het aantal B-cellen gelijk getrokken met dat van à terme kinderen, maar het totaal aantal T-cellen en T-helper cellen nog niet (Berrington 2005). Dit kan resulteren in verminderde herkenning van vreemde antigenen. Dit kan gevolgen hebben voor de immuunrespons op vaccinatie en de beschermende werking van vaccins negatief beïnvloeden (Omeñaca 2018). Echter, ondanks deze verschillen bij de geboorte zijn er ook enige studies die bij prematuren een vergelijkbare respons met die van à terme kinderen aantonen (Rouers 2020). Een recente studie beschrijft dat het immuunsysteem van prematuren zich snel aanpast na de geboorte en dan eigenlijk het stereotype patroon in het begin van het leven volgt (Olin 2018). Tegelijkertijd tonen de auteurs aan dat niet alleen de zwangerschapsduur een belangrijke factor bij de ontwikkeling van het immuunsysteem van prematuren is, maar dat ook de perinatale condities en de postnatale blootstelling van grote invloed zijn.
2.2 Bescherming door maternale antistoffen
De mate van maternale (IgG) antistofoverdracht neemt toe met de zwangerschapsduur en piekt in de tweede helft van het derde trimester (Palmeira 2012, Malek 1996). Daarom hebben prematuren lagere beschermende antistofniveaus in de eerste maanden na de geboorte dan à terme kinderen, wat vooral tot uiting komt bij de extreem vroege prematuren (<28 weken) (Omeñaca 2018, Saari 2003).
Bij deze overdracht is de concentratie van de antistoffen in het bloed van de moeder het meest bepalend voor de uiteindelijke concentratie in het bloed van de baby. Infectie bij de moeder kan het transport nadelig beïnvloeden. Overdracht van antistoffen tegen eiwitvaccins vindt beter plaats dan de overdracht van antistoffen tegen polysacharidevaccins (De Voer 2009).
2.3 Bescherming door maternale antistoffen bij moeders die tijdens de zwangerschap worden gevaccineerd
In 2015 bracht de Gezondheidsraad het advies uit om zwangere vrouwen te vaccineren tegen kinkhoest ter bescherming van hun jonge kind (Gezondheidsraad 2015). Het is een veilige en effectieve aanvulling op het vaccinatieprogramma voor het kind (Campbell 2018, Vygen-Bonnet 2020). Met het verhogen van de specifieke antistoffen wordt het volgende bereikt:
- De pasgeborene wordt in de eerste maanden beschermd door de maternale antistoffen.
- De moeder wordt zelf beschermd tijdens de zwangerschap en kan ook haar baby postpartum niet besmetten.
- Het ongeboren kind wordt beschermd.
Deze ‘maternale kinkhoestvaccinatie’ wordt middels een DKT (Difterie Kinkhoest en Tetanus)- of DKTP (Difterie, Kinkhoest, Tetanus en Poliomyelitis)-vaccin al in meer dan 20 landen geadviseerd, waaronder het Verenigd Koninkrijk (2012), België (met name in Vlaanderen) (2013), Spanje, Zwitserland, de Verenigde Staten en Australië (2013). In Nederland is de vaccinatie vanaf 16 december 2019 onderdeel van het RVP (Rijksvaccinatieprogramma) en deze wordt de 22 wekenprik genoemd.
In een Nederlandse studie (Barug 2019) is aangetoond dat een à terme gezond kind na een maternale kinkhoestvaccinatie op de leeftijd van 3 maanden nog hoge beschermende antistofniveaus tegen kinkhoest heeft, zodat de eerste vaccinatie pas op de leeftijd van 3 maanden hoeft plaats te vinden. Voor prematuren geldt dit echter niet om redenen die in paragraaf 2.2 zijn beschreven.
3. RVP-ziekten gevaarlijker voor prematuren?
3.1 Verhoogde kans op infectieziekten
Diverse studies tonen aan dat prematuur geboren kinderen een verhoogd risico hebben op infecties in het algemeen, en dus ook op infecties die door vaccinaties voorkomen kunnen worden (Bonhoeffer 2006, De Voer 2009, Schelonka 1998, Van den Berg 2010).
Dit verhoogde risico geldt ook voor kinderen met een laag geboortegewicht, wat vaak samengaat met vroeggeboorte.
Daarnaast is een verminderde vaccineffectiviteit in verschillende studies aangetoond aan de hand van lagere antistofresponsen tegen Haemophilus influenzae type b (Hib), sommige pneumokokkenserotypes, kinkhoest en Hepatitis B (HepB), en dit in het bijzonder bij de vroeg prematuren (<32 weken zwangerschap) (Omeñaca 2018).
3.2 Kinkhoest
Veel onderzoeken over dit verhoogde risico gaan over de verhoogde kans op kinkhoest. In 1996 liet een Amerikaans onderzoek zien dat kinderen met een laag geboortegewicht een verhoogd risico hadden om kinkhoest te krijgen en ook om hiervoor opgenomen te worden (Langkamp 1996). Een patiënt-controleonderzoek toonde aan dat vroeggeboorte een onafhankelijke risicofactor was voor kinkhoest (Zamir 2015). Dit verhoogde risico werd bevestigd in diverse andere onderzoeken (Riise 2017, Byrne 2017, Marshall 2015, Bhatt 2007).
Een Nederlands onderzoek van 2005-2014 liet zien dat van de kinderen tot 2 jaar die in het ziekenhuis opgenomen waren vanwege kinkhoest, 11,8% te vroeg geboren was, terwijl in Nederland gemiddeld 7,8% van de kinderen prematuur was (Van der Maas 2019). In dit onderzoek waren de prematuren ten tijde van de ziekenhuisopname ouder dan de à terme kinderen en vaker gevaccineerd. Ook hadden ze vaker co-infecties en lagen langer op de IC (Intensive care) in vergelijking met à terme kinderen. In Nederland overlijdt gemiddeld 1 jong kind per jaar aan kinkhoest. Meestal zijn deze kinderen te jong om al voor vaccinatie in aanmerking te komen.
In Denemarken en Noorwegen vond men geen verschil in vaccineffectiviteit tegen ziekenhuisopnames vanwege kinkhoest bij baby’s tussen premature en à terme kinderen (Riise 2019, Hviid 2009). In Nederland was de vaccineffectiviteit van de 1e dosis DKTP (Difterie, Kinkhoest, Tetanus en Poliomyelitis) tegen ziekenhuisopnames vanwege kinkhoest wel lager in premature kinderen dan in à terme kinderen (73%; 95%BI 20%-91% vs. 95%; 95%BI 93%-96%) (Van der Maas 2019). Dit kan mogelijk verklaard worden door het feit dat de 1e dosis van het vaccinatieprogramma in Denemarken en Noorwegen wordt gegeven op 3 maanden, terwijl dat in Nederland ten tijde van de studie op 2 maanden was. De immuunrespons is bij 3 maanden beter dan bij 2 maanden, zoals beschreven in paragraaf 2.1.
3.3 Hib
Er zijn aanwijzingen dat prematuriteit een risicofactor is voor invasieve Hib-infectie. In het Verenigd Koninkrijk vond men 18 premature kinderen bij 165 kinderen met invasieve Hib-ziekte over een periode van 8 jaar, terwijl er 12 verwacht werden (relatief risico van 1,5) (Heath 2003). Door de kleine aantallen was dit relatief risico niet significant.
In een Nederlandse studie werden de klinische karakteristieken van 51 jonge kinderen met invasieve Hib-ziekte tussen 2005 en 2013 bekeken (Monge 2018). Van deze kinderen waren er 41 gevaccineerd en 10 niet. Van de 41 gevaccineerde kinderen was er één prematuur. Geen van de ongevaccineerde kinderen was prematuur. Dit duidt niet op een verhoogd risico van invasieve Hib-ziekte of Hib-vaccinfalen, alhoewel de aantallen klein zijn.
3.4 Invasieve pneumokkenziekte
Prematuriteit is mogelijk een risicofactor voor invasieve pneumokokkenziekte. Een studie uit de Verenigde Staten vond een relatief risico van 1,6 (niet significant) (Shinefield 2002). Een studie uit Finland vond geen verschil in laboratoriumbevestigde en niet-laboratoriumbevestigde invasieve pneumokokkenziekte tussen premature en à terme kinderen (Nieminen 2019). Beide studies vonden een zeer hoge en vergelijkbare effectiviteit van pneumokokken conjugaatvaccinatie bij premature en à terme kinderen.
Een studie uit Engeland over 2013-2016 liet echter zien dat het risico op invasieve pneumokokkenziekte bij te vroeg geboren kinderen significant hoger was dan bij op tijd geboren kinderen (49/100.000 vs. 17/100.000; incidence rate 2,87; p<0.001) (Kent 2019). Extreem vroeg geboren kinderen (<28 wk zwangerschapsduur) hadden de hoogste incidentie (150/100.000). De meeste ziekte werd veroorzaakt door niet-vaccintypes (n=369, 71,4%). Het sterfterisico was 6,2%, maar wel vergelijkbaar tussen te vroeg en op tijd geboren kinderen.
In recente Nederlandse surveillancedata was het percentage prematuren bij kinderen met invasieve pneumokokkenziekte niet hoger dan in de algemene bevolking (ongepubliceerd).
4. Immunogeniciteit van vaccinaties bij prematuren
In de PRIEMA-studie, uitgevoerd in Nederland in 2015-2018, zijn bijna 300 kinderen geïncludeerd, verdeeld over 3 groepen met verschillende zwangerschapsduur: <28 weken (n=87), 28-32 weken(n=119) en 32-36 weken (n=90) (Rouers 2020). Alle prematuren kregen het normale RVP (Rijksvaccinatieprogramma)-schema met vaccinaties op 2, 3, 4 en 11 maanden. De vaccinantistofresponsen van deze prematuren zijn gemeten op 5 maanden (1 maand na de primaire serie) en op 12 maanden (1 maand na de booster) en vergeleken met een groep à terme kinderen die dezelfde vaccins met hetzelfde schema enige jaren eerder hadden gekregen. De analyses van de antistoffen laten zien dat het percentage prematuren met beschermende antistofniveaus met name voor Hib en 4-pneumokokkenserotypes duidelijk verlaagd is op de leeftijd van 5 maanden (voor Hib: 34,7 tot 46,2%; voor pneumokokkenserotypes 4, 6B, 18 C en 23F: 45,8 tot 75,1%). Ten opzichte van à terme kinderen waren de antistofconcentraties significant lager voor alle vaccincomponenten, behalve voor pertussistoxine en pneumokokkenserotypes Ps4 en Ps19F, zowel na de eerste reeks vaccinaties als na de booster op 11 maanden. Wel is na de boostervaccinatie het percentage premature kinderen met beschermende antistoffen >95% voor alle vaccincomponenten behalve Hib, waar 88,1% van de prematuren een beschermend antistofniveau bereikt. Een indeling van de prematuren op geboortegewicht (<1000g, 1000-1500g, 1500-2500g) levert nagenoeg hetzelfde beeld op (Rouers 2020). Zoals eerder vermeld is zo’n verminderde immunogeniciteit van de vaccins al eerder in verschillende studies aangetoond aan de hand van lagere antistofresponsen tegen Hib, sommige pneumokokkenserotypes, kinkhoest en Hepatitis-B, maar wel met enige heterogeniteit in de uitkomsten en zeker ook in de premature studiecohorten (Omeñaca 2018).
5. Veiligheid en bijwerkingen
Het onderzoeken van de veiligheid van vaccinaties bij te vroeg geboren kinderen is lastig, want onderliggende aandoeningen, zoals het optreden van apneus en bradycardieën, komen regelmatig voor bij prematuur geboren kinderen (Di Fiore 2016a, Di Fiore 2016b). Zo hebben kinderen geboren vóór 28 weken zwangerschapsduur bijna altijd apneus. Naarmate kinderen minder prematuur worden geboren, komen apneus minder vaak voor: van ongeveer 85% bij 30 weken tot 20% bij 34 weken zwangerschapsduur (Henderson 1981). Na vaccinatie wordt in 11%-45% weer een kortdurende toename van deze aandoeningen gezien. De spreiding wordt verklaard door verschillen in de mate van vroeggeboorte, de gebruikte casusdefinitie en de observatieperiode (Chiappini 2019). Opname en monitorbewaking tijdens de eerste vaccinaties wordt daarom soms geadviseerd (zie paragraaf 6.5). Los van het optreden van apneus en bradycardieën is het veilig om prematuren te vaccineren met hetzelfde schema als op tijd geboren kinderen (Chiappini 2019).
Milde bijwerkingen, zoals hangerigheid, huilen, prikkelbaarheid en koorts, komen wellicht iets minder vaak voor bij extreem prematuren. Mogelijk heeft dit te maken met de onrijpheid van het immuunsysteem en het gebruik van medicatie (Omenaca 2018).
6. Het vaccineren van premature kinderen
6.1 Vaccinatieschema
Per 16 december 2019 wordt binnen het RVP aan alle zwangere vrouwen een vaccinatie tegen kinkhoest aangeboden (22 wekenprik). De meeste à terme kinderen van gevaccineerde moeders zijn daarna de eerste maanden beschermd en kunnen met 3 vaccinaties, op de leeftijd van 3, 5, en 11 maanden, de basisimmuniteit opbouwen met DKTP (Difterie, Kinkhoest, Tetanus en Poliomyelitis)-Hib-HepB.
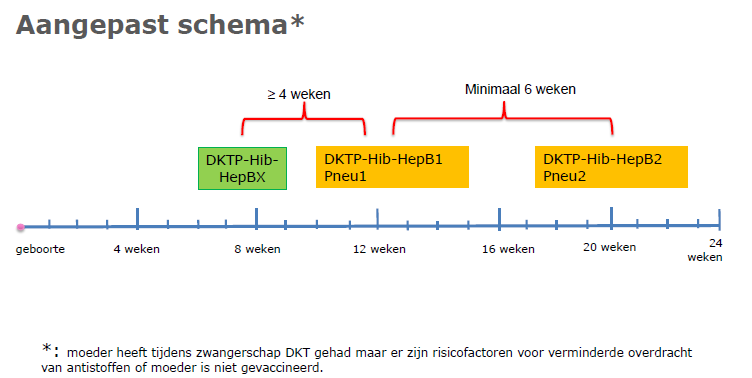
Premature kinderen starten op de leeftijd van 6-9 weken met de 1e (extra) vaccinatie waarna er nog 3 vaccinaties volgen op de leeftijd 3, 5 en 11 maanden (zie advies Gezondheidsraad 2018 en paragraaf 2.3 van deze richtlijn).
Bij dit schema krijgt een prematuur geboren kind de 1e pneumokokkenvaccinatie bij 3 maanden en de 2e bij 5 maanden. Dit kan omdat er een goede groepsimmuniteit is tegen pneumokokkenvaccintypen en deze op de kinderleeftijd niet of nauwelijks meer voorkomen. Indien een kinderarts er toch voor kiest om de 1e pneumokokkenvaccinatie bij 2 maanden te geven (bijvoorbeeld omdat de vaccinatie dan onder monitorbewaking wordt gedaan), kan de 2e pneumokokkenvaccinatie bij 5 maanden worden gegeven. Vervroeging naar 4 maanden is niet nodig. Een goede overdracht van deze 1e pneumokokkenvaccinatie bij 2 maanden naar de JGZ (Jeugdgezondheidszorg) is belangrijk om het schema goed te kunnen vervolgen.
Zie voor meer informatie over de vaccinatieschema’s de richtlijn Uitvoering RVP hoofdstuk 7 Tijdstip van vaccinaties.
6.2 Titercontrole
Titerbepaling wordt niet aanbevolen. Op basis van de PRIEMA-studie (paragraaf 4.1) weten we dat de meeste kinderen na de primaire serie goed beschermd zijn tegen de verschillende infectieziekten. Voor Hib en sommige pneumokokkenserotypen liggen de beschermingsniveaus lager, maar aangenomen wordt dat kinderen met sub-optimale titers profiteren van groepsimmuniteit tegen Hib en vaccinserotypen van de pneumokok. De incidentie hiervan is in Nederland momenteel heel laag.
6.3 Tijdig vaccineren van prematuren
Tijdig vaccineren van prematuren gebeurt volgens de kalenderleeftijd en niet volgens de gecorrigeerde leeftijd. Voor premature kinderen is tijdige vaccinatie extra belangrijk vanwege het verhoogde risico op infectieziekten.
6.4 Eerste vaccinatie in uitzonderlijke situaties op de leeftijd van 4 tot 6 weken
Alleen in uitzonderlijke situaties kan de 1e vaccinatie al vanaf de leeftijd van 4 weken worden gegeven. Een langdurige reis of een tetanusrisico kan een reden zijn om vanaf 4 weken te vaccineren. Er is wat betreft kinkhoest zelden een inhoudelijke reden om vroeger te vaccineren dan op de leeftijd van 6 weken. Bij contact met kinkhoest is antibiotica aangewezen. Zie voor meer informatie de LCI-richtlijn Kinkhoest.
6.5 Monitorbewaking
Te vroeg geboren kinderen hebben vaak een indicatie voor vaccinatie onder monitorbewaking, omdat er in de eerste 24-72 uur na vaccinatie cardiorespiratoire incidenten kunnen optreden (Buijs 2012, Meinus 2012, Clifford 2011). Het betreffen adviezen waarbij op basis van klinische argumenten kan worden afgeweken.
- < 30+0 weken AD (amenorroeduur): vaccinatie voor ontslag of heropname voor monitoring gedurende 24 uur;
- 30+0 - 31+6 weken AD: vaccinatie voor ontslag, voor zover mogelijk; heropname voor monitoring afhankelijk van risicofactoren in de voorgeschiedenis (very low birth weight < 1500 gr, bronchopulmonale dysplasie en/of ernstige ademhalingsregulatieproblemen);
- ≥ 32+0 weken AD: vaccinatie op het consultatiebureau.
Alleen indien er tijdens de 1e vaccinatie (normaliter een DKTP-Hib-HepB-vaccin) een cardiorespiratoir incident heeft voorgedaan, wordt een opname voor de 2e vaccinatie gepland. Bij een 2e vaccinatiemoment wordt normaliter de DKTP-Hib-HepB2 en Pneu1 gegeven. Zoals al beschreven in 6.1 kan de kinderarts kiezen om de 1e pneumokokkenvaccinatie toch op 2 maanden te geven, omdat er dan vaak monitorbewaking wordt geadviseerd. De tweede Pneu kan dan bij 5 maanden worden toegediend.
6.6 Interacties en relatieve contra-indicaties
Voor prematuren zijn de contra-indicaties van toepassing zoals voor alle kinderen, zie RVP-richtlijn Uitvoering RVP Contra-indicaties, inclusief de contra-indicatie voor levend verzwakte vaccins bij gebruik van biologicals (o.a infliximab) door de moeder. Het vaccineren van kinderen van moeders die tijdens de zwangerschap biologicals hebben gebruikt, is ook beschreven in de Handleiding Vaccinatie bij chronisch inflammatoire aandoeningen en in het document ‘Vaccinatie en afweerstoornissen’; een addendum van de uitvoeringsregels RVP.
Voor interacties zie RVP-richtlijn Uitvoering, hoofdstuk Combinatievaccins, simultaan vaccineren en intervallen.
6.7 Overwegingen om vaccinatie uit te stellen bij prematuren
Het is van belang om prematuren tijdig te vaccineren en de vaccinaties niet onnodig uit te stellen. Alle vaccinaties die momenteel voor de 1e verjaardag volgens het RVP gegeven worden, zijn geïnactiveerde vaccins en kunnen daarom in principe veilig gegeven worden (zie 6.6 voor relatieve contra-indicaties). In individuele gevallen kan er besloten worden om de vaccinaties uit te stellen, bijvoorbeeld als er sprake is van een instabiele situatie met risico op verslechtering. Uitstel kan overwogen worden als door vaccinatie mogelijk het verloop van een onderliggende aandoening of het effect van een operatieve ingreep niet goed geëvalueerd kan worden (gevolg van vaccinatie of van onderliggende aandoening).
De vaccinrespons is lager bij gebruik van hoge dosis corticosteroïden (Robinson 2004). Het is te overwegen om de vaccinatie uit te stellen als de neonaat op dat moment behandeld wordt met hoge dosis corticosteroïden, bijvoorbeeld in het kader van bronchopulmonaire dysplasie (BPD), zie document ‘Vaccinatie en afweerstoornissen’, een addendum van de uitvoeringsregels RVP en Handleiding Vaccinatie bij chronisch inflammatoire aandoeningen). Het toedienen van bloed(producten) en/of immunoglobulinen op zich is geen reden om vaccinatie met geïnactiveerde vaccins uit te stellen.
De voor-en nadelen van het uitstellen van vaccinatie dienen altijd individueel afgewogen te worden door de behandelend neonatoloog.
6.8 Registratie van de vaccinatie
Centrale registratie: een toegediende vaccinatie kan worden doorgegeven aan het RIVM (Rijksinstituut voor Volksgezondheid en Milieu) met behulp van het vaccinatieregistratieformulier. Dit geldt ook voor een eventuele rotavirusvaccinatie, die op indicatie van de kinderarts kan worden gegeven. De JGZ geeft toegediende vaccinaties door via het DD JGZ.
Registratie op het vaccinatiebewijs: op het RVP-vaccinatiebewijs worden de vaccinatie(s) genoteerd. De indicatie voor het DKTP-schema kan ook door de jeugdarts of kinderarts aangekruist worden op het vaccinatiebewijs.
7. Organisatie van zorg
7.1 Vaccinatie in het ziekenhuis
Soms ligt het kind bij de 1e vaccinatie nog in het ziekenhuis en valt het onder de tweede- of derdelijnszorg (kindergeneeskunde). Ziekenhuisapothekers kunnen kosteloos RVP (Rijksvaccinatieprogramma)-vaccins bestellen bij RIVM (Rijksinstituut voor Volksgezondheid en Milieu)-DVP en laten bezorgen. Elk ziekenhuis heeft sinds kort een RVP-coördinator (nieuw per 2020 en in opdracht vanuit het ministerie van VWS (Ministerie van Volksgezondheid, Welzijn en Sport)). Deze kinderarts heeft als taak het vaccineren in het kader van het RVP binnen het ziekenhuis te coördineren en beleid af te stemmen met de JGZ (Jeugdgezondheidszorg).
7.2 Overdracht
Vaccinatie in het kader van het RVP wordt gezamenlijk uitgevoerd door kinderartsen en jeugdartsen. Voor een goede zorg is het noodzakelijk dat medische gegevens uitgewisseld worden tussen de kinderarts die een kind in zorg heeft en de betrokken jeugdarts, zowel om tijdig vaccinaties toe te dienen als om contra-indicaties goed toe te passen. Hier is sprake van medebehandelaarschap en verwijzing. De juridische basis voor de uitwisseling van medische gegevens is te vinden in de KNMG-richtlijn Omgaan met medische gegevens. Tenzij er nadrukkelijk bezwaar wordt gemaakt, mogen kinderartsen en jeugdartsen in het belang van het kind medische gegevens uitwisselen op basis van expliciete of veronderstelde toestemming.
Uitwisseling van medische gegevens is een doorbreking van het beroepsgeheim. Dit is toegestaan als de patiënt (in dit geval de ouder) hiervoor toestemming verleent. Als niet expliciet om toestemming gevraagd is, kan er sprake zijn van ‘veronderstelde toestemming van de patiënt’ (zie. 7.4.2 p. 130 KNMG-richtlijn). Dit is het geval:
- Bij verwijzing (verwijsbrief en specialistenbrief, zie p. 22 KNMG-richtlijn) van kinderarts naar jeugdarts of andersom. Van verwijzing is bijvoorbeeld sprake als de jeugdarts een vaccinatieserie afmaakt die door de kinderarts is gestart volgens de richtlijn uitvoering RVP.
- Wanneer beide ‘medebehandelaars’ zijn. Medebehandelaars zijn personen die rechtstreeks betrokken zijn bij de behandeling van de patiënt. In dit geval is de vaccinatie de behandeling (zie p. 23 KNMG-Richtlijn). Van medebehandeling is sprake bij uitwisseling van contra-indicaties voor vaccinatie.
De inhoud van de gedeelde informatie (telefonisch als het snel moet of via een brief) moet betrekking hebben op de RVP-vaccinaties, maar omdat zowel de JGZ als de kinderarts een bredere zorgtaak heeft voor het kind, kan dit ruim opgevat worden.
Bij voorkeur is er naast de schriftelijke overdracht ook een ‘warme’ overdracht, waarbij de zorg mondeling wordt overgedragen aan de professionals van de jeugdgezondheidszorg. Zie ook de NCJ-richtlijn Vroeg en/of small voor gestational age (SGA) geboren kinderen (inclusief de NCJ Handreiking gegevensoverdracht).
Een overzicht van de JGZ-organisaties in Nederland en hun werkgebied is te vinden via www.opvoeden.nl/cjg.
7.3 Vervolg na ontslag uit het ziekenhuis
De nazorg voor prematuren is verschillend georganiseerd in Nederland. De volgende mogelijkheden worden geboden:
- vervolgvaccinaties via de JGZ;
- reguliere zorg via de JGZ, maar heropname voor de vaccinatie;
- polikliniek voor prematuren, waar een jeugdarts en/of een kinderarts de kinderen ziet en vaccineert.
Referenties
- Barug D, Pronk I, van Houten MA, Versteegh FGA, Knol MJ, van de Kassteele J, et al. Maternal pertussis vaccination and its effects on the immune response of infants aged up to 12 months in the Netherlands: an open-label, parallel, randomised controlled trial. Lancet Infect Dis. 2019;19(4):392-401. https://pubmed.ncbi.nlm.nih.gov/30938299/
- Berrington JE, Barge D, Fenton AC, Cant AJ, Spickett GP. Lymphocyte subsets in term and significantly preterm UK infants in the first year of life analysed by single platform flow cytometry. Clinical and experimental immunology. 2005;140(2):289-92. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1809375/
- Bhatt P, Halasa N. Increasing rates of infants hospitalized with pertussis. Tenn Med. 2007;100(5):37-9, 42.
- Bonhoeffer J, Siegrist CA, Heath PT. Immunisation of premature infants. Arch Dis Child. 2006;91(11):929-35. https://pubmed.ncbi.nlm.nih.gov/17056868/
- Buijs SC, Boersma B. [Cardiorespiratory events after first immunization in premature infants: a prospective cohort study]. Nederlands tijdschrift voor geneeskunde. 2012;156(3):A3797.
- Byrne L, Campbell H, Andrews N, Ribeiro S, Amirthalingam G. Hospitalisation of preterm infants with pertussis in the context of a maternal vaccination programme in England. Arch Dis Child. 2017.
- Campbell H, Gupta S, Dolan GP, Kapadia SJ, Kumar Singh A, Andrews N, et al. Review of vaccination in pregnancy to prevent pertussis in early infancy. J Med Microbiol. 2018;67(10):1426-56. https://pubmed.ncbi.nlm.nih.gov/30222536/
- Chiappini E, Petrolini C, Sandini E, Licari A, Pugni L, Mosca FA, et al. Update on vaccination of preterm infants: a systematic review about safety and efficacy/effectiveness. Proposal for a position statement by Italian Society of Pediatric Allergology and Immunology jointly with the Italian Society of Neonatology. Expert Rev Vaccines. 2019;18(5):523-45.
- Clifford V, Crawford NW, Royle J, Lazzaro T, Danchin M, Perrett KP, et al. Recurrent apnoea post immunisation: Informing re-immunisation policy. Vaccine. 2011;29(34):5681-7.
- De Voer RM, van der Klis FR, Nooitgedagt JE, Versteegh FG, van Huisseling JC, van Rooijen DM, et al. Seroprevalence and placental transportation of maternal antibodies specific for Neisseria meningitidis serogroup C, Haemophilus influenzae type B, diphtheria, tetanus, and pertussis. Clin Infect Dis. 2009;49(1):58-64.
- Di Fiore JM, Poets CF, Gauda E, Martin RJ, MacFarlane P. Cardiorespiratory events in preterm infants: etiology and monitoring technologies. J Perinatol. 2016;36(3):165-71.
- Di Fiore JM, Poets CF, Gauda E, Martin RJ, MacFarlane P. Cardiorespiratory events in preterm infants: interventions and consequences. J Perinatol. 2016;36(4):251-8.
- Gezondheidsraad. Vaccinatie tegen kinkhoest: doel en strategie. Den Haag: Gezondheidsraad; 2015.
- Gezondheidsraad. Vaccinatieschema zuigelingen na maternale kinkhoestvaccinatie. Den Haag: Gezondheidsraad; 2018. Report No.: 2018/27.
- Heath PT, Booy R, McVernon J, Bowen-Morris J, Griffiths H, Slack MP, et al. Hib vaccination in infants born prematurely. Arch Dis Child. 2003;88(3):206-10.
- Henderson-Smart DJ. The effect of gestational age on the incidence and duration of recurrent apnoea in newborn babies. Aust Paediatr J. 1981;17(4):273-6.
- Hviid A. Effectiveness of two pertussis vaccines in preterm Danish children. Vaccine. 2009;27(23):3035-8.
- Kent A, Makwana A, Sheppard CL, Collins S, Fry NK, Heath PT, et al. Invasive Pneumococcal Disease in UK Children <1 Year of Age in the Post-13-Valent Pneumococcal Conjugate Vaccine Era: What Are the Risks Now? Clin Infect Dis. 2019;69(1):84-90.
- Langkamp DL, Davis JP. Increased risk of reported pertussis and hospitalization associated with pertussis in low birth weight children. J Pediatr. 1996;128(5 Pt 1):654-9. https://pubmed.ncbi.nlm.nih.gov/8627438/
- Malek A, Sager R, Kuhn P, Nicolaides KH, Schneider H. Evolution of maternofetal transport of immunoglobulins during human pregnancy. American journal of reproductive immunology. 1996;36(5):248-55. https://pubmed.ncbi.nlm.nih.gov/8955500/
- Marshall H, Clarke M, Rasiah K, Richmond P, Buttery J, Reynolds G, et al. Predictors of disease severity in children hospitalized for pertussis during an epidemic. Pediatr Infect Dis J. 2015;34(4):339-45.
- Meinus C, Schmalisch G, Hartenstein S, Proquitte H, Roehr CC. Adverse cardiorespiratory events following primary vaccination of very low birth weight infants. J Pediatr (Rio J). 2012;88(2):137-42.
- Melville JM, Moss TJ. The immune consequences of preterm birth. Front Neurosci. 2013;7:79 https://pubmed.ncbi.nlm.nih.gov/23734091/.
- Monge S, Mollema L, de Melker H, Sanders E, van der Ende A, Knol M. Clinical Characterization of Invasive Disease Caused by Haemophilus influenzae Serotype b in a High Vaccination Coverage Setting. J Pediatric Infect Dis Soc. 2018.
- Nieminen H, Rinta-Kokko H, Jokinen J, Puumalainen T, Moreira M, Borys D, et al. Effectiveness of the 10-valent pneumococcal conjugate vaccine among girls, boys, preterm and low-birth-weight infants - Results from a randomized, double-blind vaccine trial. Vaccine. 2019;37(28):3715-21.
- Olin A, Henckel E, Chen Y, Lakshmikanth T, Pou C, Mikes J, et al. Stereotypic Immune System Development in Newborn Children. Cell. 2018;174(5):1277-92 e14. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6108833/
- Omenaca F, Vazquez L, Garcia-Corbeira P, Mesaros N, Hanssens L, Dolhain J, et al. Immunization of preterm infants with GSK's hexavalent combined diphtheria-tetanus-acellular pertussis-hepatitis B-inactivated poliovirus-Haemophilus influenzae type b conjugate vaccine: A review of safety and immunogenicity. Vaccine. 2018;36(7):986-96.
- Palmeira P, Quinello C, Silveira-Lessa AL, Zago CA, Carneiro-Sampaio M. IgG placental transfer in healthy and pathological pregnancies. Clin Dev Immunol. 2012;2012:985646. https://pubmed.ncbi.nlm.nih.gov/22235228/
- Perinatale zorg in Nederland anno 2018 Landelijke perinatale cijfers en duiding (pdf)
- Riise OR, Laake I, Vestrheim D, Flem E, Moster D, Riise Bergsaker MA, et al. Risk of Pertussis in Relation to Degree of Prematurity in Children Less Than 2 Years of Age. Pediatr Infect Dis J. 2017;36(5):e151-e6.
- Robinson MJ, Heal C, Gardener E, Powell P, Sims DG. Antibody response to diphtheria-tetanus-pertussis immunization in preterm infants who receive dexamethasone for chronic lung disease. Pediatrics. 2004;113(4):733-7. https://pubmed.ncbi.nlm.nih.gov/15060220/
- Rouers EDM, Bruijning-Verhagen PCJ, van Gageldonk PG, van Dongen JAP, Sanders EAM, Berbers GAM. Association of routine infant vaccinations with antibody levels among preterm infants: a multicentre prospective observational cohort study in the Netherlands. . accepted for publication in JAMA. 2020.
- Saari TN, American Academy of Pediatrics Committee on Infectious D. Immunization of preterm and low birth weight infants. American Academy of Pediatrics Committee on Infectious Diseases. Pediatrics. 2003;112(1 Pt 1):193-8. https://pubmed.ncbi.nlm.nih.gov/12837889/
- Schelonka RL, Infante AJ. Neonatal immunology. Semin Perinatol. 1998;22(1):2-14. https://pubmed.ncbi.nlm.nih.gov/9523395/
- Shinefield H, Black S, Ray P, Fireman B, Schwalbe J, Lewis E. Efficacy, immunogenicity and safety of heptavalent pneumococcal conjugate vaccine in low birth weight and preterm infants. Pediatr Infect Dis J. 2002;21(3):182-6.
- Van den Berg JP, Westerbeek EA, Berbers GA, van Gageldonk PG, van der Klis FR, van Elburg RM. Transplacental transport of IgG antibodies specific for pertussis, diphtheria, tetanus, haemophilus influenzae type b, and Neisseria meningitidis serogroup C is lower in preterm compared with term infants. Pediatr Infect Dis J. 2010;29(9):801-5.
- Van der Maas NAT, Sanders EAM, Versteegh FGA, Baauw A, Westerhof A, de Melker HE. Pertussis hospitalizations among term and preterm infants: clinical course and vaccine effectiveness. BMC Infect Dis. 2019;19(1):919. https://www.rivm.nl/publicaties/pertussis-hospitalizations-among-term-a…
- Vygen-Bonnet S, Hellenbrand W, Garbe E, von Kries R, Bogdan C, Heininger U, et al. Safety and effectiveness of acellular pertussis vaccination during pregnancy: a systematic review. BMC Infect Dis. 2020;20(1):136. https://bmcinfectdis.biomedcentral.com/articles/10.1186/s12879-020-4824…
- Zamir CS, Dahan DB, Shoob H. Pertussis in infants under one year old: risk markers and vaccination status--a case-control study. Vaccine. 2015;33(17):2073-8.